发布时间:2018-06-06 09:26 类别:医学前沿资讯 标签: 来源:转化医学网 作者:医学资源分享
我们所处的世界,并非静止的、孤立的,而是动态的、联系的世界 ;事物的发展都有一个过程 ,由外部矛盾和内部矛盾共同作用而推动事物的发展,而疾病的发生也不外乎如此。
外界环境因素的作用和(或)机体自身的物质代谢异常导致机体内环境的紊乱进而促成疾病的发生。与此相反,我们是否能够通过早期发现机体分子水平的物质代谢异常进而预测后期疾病的发生呢?
近日,一项发表于国际著名杂志《细胞代谢》的研究显示:脂肪的低效分解能够预测机体后期体重的增加和发生代谢并发症的风险(如女性的2型糖尿病)。
生理学上,机体能量的利用和储存过程主要涉及葡萄糖代谢和脂质代谢,人体摄入的食物通过消化道的分解和吸收,最终在血液中主要以葡萄糖的形式存在。
葡萄糖通过分解代谢产生能量以维持生命活动的正常进行,多余的葡萄糖则主要转化为脂肪,为机体储存能量。当机体急需能量的时候,再由脂肪细胞通过分解作用产生能量供机体使用,这就是能量代谢的大致过程(其中脂解过程分为自发性和激素刺激性两种形式)。
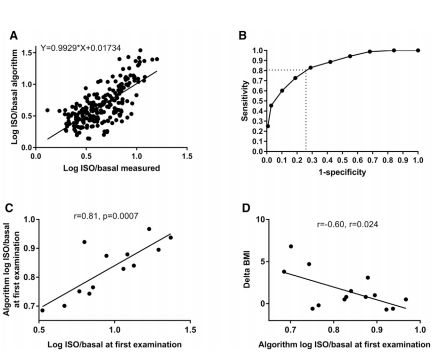
因此,一旦脂肪分解代谢不足或葡萄糖利用过程受损,将导致体内脂肪堆积,表现为体重增加。基于上述原理,研究人员设计实验的过程中开发了一种算法,即通过临床和血液分析来检测激素刺激脂解过程的低效能和可能发生的葡萄糖代谢过程损伤。
研究人员构建的这种算法,与传统的组织活检方式不一样,其原理是根据临床和血液分析的手段来估计激素刺激的脂解过程。
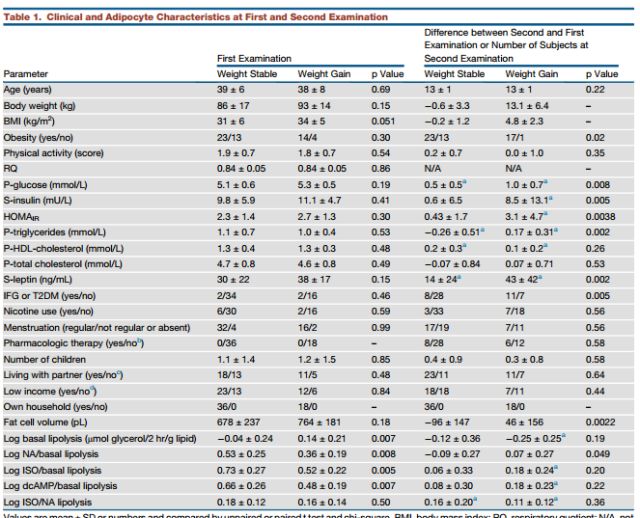
在研究过程中,研究人员为了确定这种代谢测量的具体参数,他们分析了1045名受试者的数据,最后确定将腰围、空腹血浆高密度脂蛋白胆固醇、空腹血浆肾上腺素、体重、空腹血清胰岛素和空腹血浆甘油除以总体脂作为本次研究中测量的6项参数指标。
接着在检测226名受试者的过程中,该算法展现出令人惊讶地效果---预测高或低脂活性的敏感性大于80%,特异性约为75%。
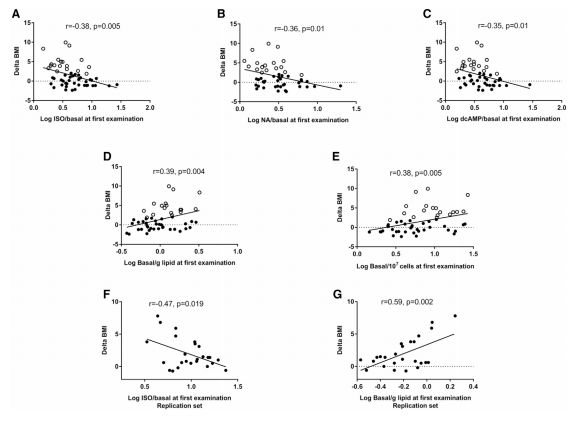
另外,当在单独的14名受试者中进行测试时,该算法与激素刺激脂解水平和预测的体重随时间变化的水平高度重合。此外,为了增加研究结果的可信度,Rydén和他的团队13年后还曾对89名女性(最初她们都是健康且不肥胖的)进行了皮下脂肪组织活检。
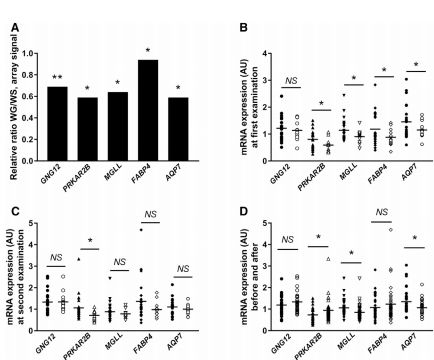
结果显示:与体重稳定的个体相比,中期体重增加的女性自发脂解增加了50%,激素刺激的脂解减少了50%。同时,他还发现,参与调节脂解的基因的低表达与后期体重增加有关。
对此,卡罗林斯卡学院的资深作家MikaelRyden表示:“我们提出的算法可以帮助识别超重或肥胖风险高的受试者,帮助临床医生去利用这一信息来判断哪些受试者能够从该实验中实施的强化生活方式干预(高效体育锻炼)中获益最大。
该干预措施是通过运动来增强激素刺激的脂解,从而防止脂肪积累和代谢紊乱,并且这些算法可以用来代替常规临床背景下的组织活检来估计激素刺激下的脂解。”
最后, 本次研究报告的第一作者卡罗拉斯卡学院的Peter Arner教授说道:“我们的研究结果表明,脂肪分解不足(即高基础脂解不能充分通过激素刺激加速),可能会将脂质代谢的平衡点转向脂类物质的摄取,从而促进脂肪的大量合成,导致体重增加。”
然而,由于本次研究样本量的限制,因此未来的研究需要在更大的群体中去验证这一算法,并确定这项研究的结果是否也适用于男性群体,以便进一步推广到所有群体。
疾病的发生,往往涉及的不是某个单一因素,更多的是多因素综合作用的结果。既往的研究更多的是关注于外界环境因素(如饮食)在疾病发生过程中的作用。
而本次研究则聚焦于机体内在过程的代谢紊乱在疾病发生过程中的角色,这为疾病的病因学研究提供了新的参考;代谢指标的检测也为早期疾病的诊断和预防提供了客观的依据,具有重要的临床价值。
参考文献:
1, Andersson, D., Wahrenberg, H., and Lofgren, P. (2009). Beta3-adrenoceptor function and long-term changes in body weight. Int. J. Obes. 33, 662–668.
2, Andersson, D.P., Eriksson Hogling, D., Thorell, A., Toft, E., Qvisth, V., Naslund, E., Thorne, A., Wiren, M., Lofgren, P., Hoffstedt, J., et al. (2014). Changes in subcutaneous fat cell volume and insulin sensitivity after weight loss. Diabetes Care 37, 1831–1836
3, Arner, P. (2005). Human fat cell lipolysis: biochemistry, regulation and clinical role. Best Pract. Res. Clin. Endocrinol. Metab. 19, 471–482